 Tra gli idrocarburi alifatici, oltre agli alcani e ai cicloalcani, che sono saturi, ne esistono altri che sono insaturi, aventi nella molecola uno o più legami tra atomi di carbonio.
Tra gli idrocarburi alifatici, oltre agli alcani e ai cicloalcani, che sono saturi, ne esistono altri che sono insaturi, aventi nella molecola uno o più legami tra atomi di carbonio.
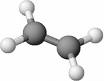
Gli idrocarburi insaturi sono specie chimiche in cui solo una parte dei legami disponibili è saturata da atomi di idrogeno. Gli alcheni appartengono alla classe degli idrocarburi insaturi perché presentano un doppio legame carbonio-carbonio e quindi il numero di atomi di idrogeno in essi contenuti è inferiore a quello degli alcani con egual numero di atomi di carbonio.
Ad esempio, il termine a quattro atomi di carbonio ha la formula molecolare C4H8, mentre il corrispondente alcano ha la formula C4H10 perché ha due atomi di idrogeno in più.
Gli alcheni sono idrocarburi contenenti due atomi di carbonio sp2 tra i quali si instaura un doppio legame. La loro formula generale è CnH2n.
La presenza del doppio legame impedisce la libera rotazione dei carboni e costringe gli atomi che lo formano e quelli a essi legati a stare su un unico piano. Inoltre l’ibridazione sp2 impone angoli di legame di 120°.
Il nome tradizionale del nome del gruppo è olefine: il termine deriva dal fatto che questi idrocarburi, sommando gli alogeni, si trasformano in sostanze liquide di aspetto oleoso. In particolare deriva dal comportamento dell’etilene, il più semplice alchene che produce una sostanza di consistenza oleosa reagendo con il cloro.
Le regole IUPAC adoperate per la nomenclatura degli alcheni sono simili a quelle usate per gli alcani, ma occorre aggiungere qualche altra regola per consentire di assegnare il nome e fissare la posizione del doppio legame nella catena:
– la presenza del doppio legame viene indicata dal suffisso -ene che sostituisce il suffisso –ano del corrispondente alcano; per cui il nome dell’alchene si ottiene dal nome del corrispondente alcano. Ad esempio all’etano (C2H6) corrisponde l’etene o etilene (C2H4);
– la numerazione degli atomi di carbonio nella catena deve essere fatta in modo che gli atomi di carbonio portanti il doppio legame abbiano i numeri più piccoli possibili; sebbene il doppio legame unisca due atomi di carbonio, per assegnare la sua posizione basta indicare il numero del primo atomo di carbonio impegnato nel doppio legame. Pertanto, l’alchene sarà denominato 1-butene perché il doppio legame che si è instaurato è tra il carbonio 1 e il carbonio 2;
– se alla catena sono anche legati dei gruppi alchilici, questi ultimi saranno contrassegnati da numeri corrispondenti agli atomi di carbonio ai quali sono legati.
All’etene segue, con tre atomi di carbonio, il propene o propilene con formula C3H6.
Bisogna inoltre ricordare che negli alcheni solo gli atomi di carbonio che partecipano al doppio legame sono ibridati sp2: gli altri sono sempre ibridati sp3.
Nello specifico, quando il carbonio forma doppi legami non può utilizzare, come nel caso degli alcani, i suoi quattro orbitali ibridi sp3. Anche il carbonio alchenico è ibridato, ma non tutti e quattro i suoi orbitali atomici di partenza si mescolano a formare orbitali ibridi: un orbitale atomico di tipo p deve infatti rimanere invariato per partecipare alla formazione del doppio legame.
I restanti orbitali (un orbitale s e due orbitali p) si mescolano e formano tre orbitali ibridi isoenergetici orientati a 120° verso i vertici di un tetraedro equilatero che prendono il nome di orbitali ibridi sp2. Il piano degli orbitali ibridi è perpendicolare al piano su cui giace l’orbitale p rimasto non ibridato. Due dei tre orbitali ibridi sp2 sono utilizzati per legami semplici; il terzo orbitale ibrido sp2 partecipa insieme al p non ibridato alla formazione del doppio legame.
Quando la catena di carbonio si allunga, è necessario indicare la posizione del doppio legame.
Il radicale che si ottiene sottraendo un atomo di idrogeno a un alchene, prende la desinenza in -enile. Ad esempio:
– se dall’etano CH3―CH3 saturo si ricava il radicale etilico o etile CH3―CH2―, dall’etene CH2=CH2 si ricava l’etenile CH2=CH― chiamato comunemente vinile o radicale vinilico;
– dal propene CH2=CH―CH3 si ricava il 2-propenile CH2=CH―CH2― chiamato comunemente allile o radicale allilico.
Il nome 2-propenile deriva dal fatto che nei radicali la numerazione comincia sempre dall’atomo di carbonio capace di legarsi a una catena principale.
Se nella molecola degli alcheni compare più di un doppio legame, essi vengono detti polieni e la loro formula generale varia con il numero k dei doppi legami presenti nella molecola. Ricordando che ogni doppio legame comporta due atomi di idrogeno in meno rispetto agli alcani saturi, un poliene ha (2n + 2) – 2k atomi di idrogeno, quindi la formula generale è CnH(2n+2)-2k.
I polieni più comuni sono:
– gli alcheni con due doppi legami e formula generale CnH2n-2, detti dieni;
– gli alcheni con tre doppi legami e quindi formula generale Cn H2n-4, detti trieni.
Essi si scrivono indicando il primo atomo di carbonio dei doppi legami.
Di particolare interesse sono i dieni: essi vengono ottenuti in grande quantità dal petrolio; costituiscono la materia prima per la produzione della gomma sintetica.
In generale, però, si può dire che tutti gli idrocarburi insaturi sono di notevole interesse per le reazioni di polimerizzazione.
L’etene è l’idrocarburo insaturo più importante dal punto di vista industriale: oltre che per la produzione di materie plastiche è utilizzato anche per la sintesi di alcool etilico.
Fanno parte degli alcheni anche i cicloalcheni. Analogamente ai cicloalcani, i cicloalcheni sono idrocarburi con struttura ad anello in cui è presente almeno un doppio legame tra due atomi di carbonio. La formula generale dei cicloalcheni è CnH2n-2.
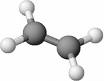 Gli idrocarburi alifatici insaturi possono presentare vari tipi di isomeria, per cui composti aventi la stessa formula grezza hanno struttura e proprietà totalmente diverse.
Gli idrocarburi alifatici insaturi possono presentare vari tipi di isomeria, per cui composti aventi la stessa formula grezza hanno struttura e proprietà totalmente diverse.
