L’ibridazione sp2 e il doppio legame
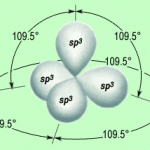
L’ibridazione sp3 non è l’unica possibile con gli orbitali del carbonio; talvolta, nella sua ibridazione, l’atomo di carbonio può coinvolgere anche solo uno, oppure due dei tre orbitali p disponibili, per dar luogo, con l’orbitale 2s, rispettivamente a due o tre orbitali ibridi.
Quindi l’atomo di carbonio può utilizzare un altro tipo di ibridazione che coinvolge l’orbitale s e due dei tre orbitali p formando così tre orbitali ibridi equivalenti che giacciono su un piano passante per il nucleo dell’atomo di carbonio e per gli assi degli orbitali sp2 diretti verso i vertici di un triangolo equilatero con l’angolo di 120°. L’orbitale p non coinvolto si dispone in posizione perpendicolare al piano del triangolo equilatero formato dai tre orbitali ibridi sp2.
I tre orbitali ibridi così ottenuti sono detti orbitali ibridi del tipo sp2. Il carbonio ibridizzato sp2 si definisce carbonio insaturo.
Come si può notare, quindi, gli orbitali ibridi scelgono l’assetto più stabile, cioè quello che consente loro di disporsi alla massima distanza gli uni dagli altri per ridurre al minimo la loro repulsione.
I tre orbitali ibridi ottenuti presentano per 1/3 le caratteristiche dell’orbitale 2s e per 2/3 le caratteristiche degli orbitali 2p; quindi richiedono da parte degli elettroni una quantità di energia intermedia tra 2s e 2p, ma leggermente inferiore a quella degli orbitali ibridi sp3.
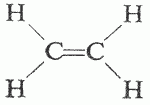
Quando due atomi di carbonio così ibridati si legano tra di loro, sovrapponendo due dei loro orbitali sp2 e formando un legame σ, gli altri quattro orbitali sp2 possono sovrapporsi agli orbitali 1s di altrettanti atomi di idrogeno. La molecola dell’etilene C2H4 presenta questo tipo di ibridazione e risulta apparentemente anomala in quanto i suoi atomi di carbonio non rispettano la disposizione tetraedrica.
Se, però, immaginiamo di allineare i due atomi di carbonio in modo tale che gli orbitali p non ibridi siano paralleli, questi ultimi possono sovrapporsi parallelamente e non lungo la loro direzione, formando un diverso tipo di legame, detto π (pi greco).
Di conseguenza si stabiliscono due legami tra i due atomi di carbonio, e cioè uno forte σ e uno più debole π, e si definisce questo doppio legame tra i due atomi di carbonio così saldamente legati.
E’ stato possibile misurare la forza totale del doppio legame C⚌C corrispondente a 146 Kcal/mol, di cui 95 Kcal/mol dovute al legame σ e 51 Kcal/mol dovute al legame π. La forza leggermente superiore del legame σ è dovuto alla minore distanza tra i due atomi di carbonio che nell’etilene è di 1,34 Å anziché 1,53 Å misurati per l’etano.
Ai due atomi di carbonio possono legarsi anche altri atomi di carbonio ibridati sp3 o sp2 formando così molecole lineari, ramificate o cicliche aventi uno o più doppi legami.
Il doppio legame C=C rende impossibile la rotazione attorno al legame, in quanto questa comporterebbe la rottura del legame π tra i due atomi di carbonio.
La rotazione, però, non avviene né a temperatura ambiente né a temperature più elevate, in quanto per la rottura del legame π occorre una considerevole quantità di energia.



 Qualche decennio dopo, J. von Liebig analizzò accuratamente la composizione di un gran numero di sostanze organiche e fu capace di dimostrare che esse risultano dalla composizione di un numero limitato di elementi, ossia carbonio, idrogeno, ossigeno e azoto. L’analisi rivelò due fattori importanti:
Qualche decennio dopo, J. von Liebig analizzò accuratamente la composizione di un gran numero di sostanze organiche e fu capace di dimostrare che esse risultano dalla composizione di un numero limitato di elementi, ossia carbonio, idrogeno, ossigeno e azoto. L’analisi rivelò due fattori importanti: Kekulé e Couper riuscirono a spiegare la formazione di molecole organiche molto complesse applicando il concetto di valenza ai composti organici, già noto in chimica inorganica. Essi fornirono un metodo efficiente e semplice per rappresentare molecole molto organiche anche notevolmente complesse.
Kekulé e Couper riuscirono a spiegare la formazione di molecole organiche molto complesse applicando il concetto di valenza ai composti organici, già noto in chimica inorganica. Essi fornirono un metodo efficiente e semplice per rappresentare molecole molto organiche anche notevolmente complesse.